Halo Sobat100, melanjutkan pekan Hadiah Nobel artikel kali ini membahas di bidang Kimia. Pengumuman diadakan pada Rabu, 9 Oktober 2019 pukul 11.45 waktu Swedia atau 16.45 WIB. Seperti halnya pada bidang Fisika pengumuman Hadiah Nobel bidang Kimia berlangsung di Royal Swedish Academy of Sciences, Sessionssalen, Lilla Frescativägen 4A, Stockholm. Hadiah Nobel bidang Kimia tahun 2019 dimenangkan oleh John B. Goodenough, M. Stanley Whittingham, dan Akira Yoshino atas penemuan baterai ion litium.
1. Latar Belakang
Prinsip kerja baterai relatif mudah dalam konfigurasi dasarnya (Gambar 1). Sel ini terdiri dari dua elektroda, masing-masing terhubung ke sirkuit listrik, dipisahkan oleh elektrolit yang dapat menampung spesies bermuatan. Seringkali, elektroda secara fisik dipisahkan oleh bahan penghalang yang mencegah keduanya melakukan kontak fisik dengan satu lain, yang akan menyebabkan baterai mengalami arus pendek (shortcut).
Dalam mode pengosongan, saat baterai berfungsi untuk menggerakkan arus listrik, proses oksidasi berlangsung di elektroda negatif (anoda), menghasilkan elektron yang bergerak dari elektroda melalui rangkaian. Sebuah pelengkap proses reduksi berlangsung di elektroda positif (katoda), diisi kembali oleh elektron dari sirkuit. Tegangan sel sangat tergantung pada perbedaan potensial dari elektroda, dan keseluruhan prosesnya spontan.
Untuk baterai isi ulang (sekunder) prosesnya dapat dibalik dan listrik eksternal dapat digunakan untuk menghasilkan reaksi redoks komplementer pada elektroda. Proses ini bergantung pada energi dan tidak spontan.
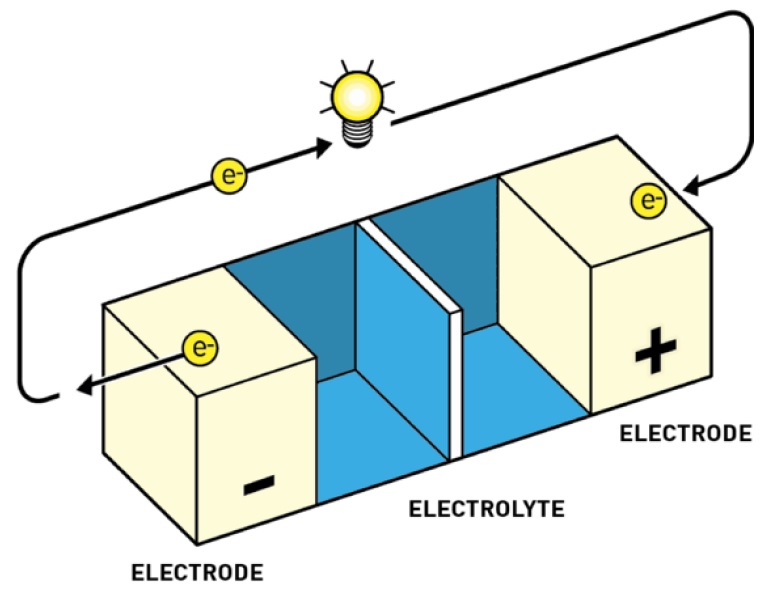
Gambar 1. Prinsip kerja baterai dasar dalam mode pengosongan (elemen Galvanik).
Proses redoks spontan pada elektroda menghasilkan arus listrik melalui rangkaian. Dalam mode pengisian (sel elektrolitik), proses redoks yang digerakkan oleh listrik berlangsung di elektroda yang menghasilkan pembalikan proses spontan.
Lapisan sel Volta terbuat dari cakram bergantian dari dua logam, satu di antaranya timah atau seng dan yang lainnya tembaga atau perak, dipisahkan oleh lapisan kardus atau kulit yang direndam dalam elektrolit cair.[1] Setiap pasang cakram logam dan lapisan elektrolit membentuk sel baterai, dan lapisan itu terdiri dari sekitar 20 sel yang ditumpuk.
Selama operasi, dalam kasus sel Zn / Cu, logam seng bertindak sebagai anoda, melepaskan elektron ke sirkuit dan menghasilkan ion logam (oksidasi), sedangkan reaksi elektroda yang berlawanan tergantung pada kondisi kerja. Dengan adanya udara, logam tembaga menjadi teroksidasi sebagian menjadi CuO, dan reduksi CuO menjadi Cu terjadi di elektroda. Dengan tidak adanya udara, proton dalam elektrolit malah direduksi menjadi gas hidrogen pada permukaan tembaga.
Tegangan sel kira-kira 0,8-1,1 V, tergantung pada paparan udara.[2] Sel Volta pada dasarnya adalah baterai primer dan tidak dapat diisi ulang. Saat menghubungkan kutub seluruh perangkat, Volta dapat menunjukkan bagaimana arus yang dihasilkan dapat menimbulkan percikan api. Setelah menunjukkan penemuannya kepada Napoleon Bonaparte, Konsul Pertama Republik Cisalpine sangat terkesan sehingga ia segera menjadikan Volta sebuah hitungan.[3]
Baterai timbal-asam (yang masih digunakan sebagai baterai starter di mobil) dipelajari oleh Wilhelm J. Sinsteden pada awal 1854 dan didemonstrasikan oleh Gaston Planté pada 1859–1860.[2] Baterai memiliki prinsip kerja mirip dengan Sel Volta yang terpapar udara, tetapi merupakan baterai sekunder pertama yang dapat diisi ulang.
Istilah sekunder berasal dari studi awal oleh Nicolas Gautherot, yang pada 1801 mengamati arus sekunder pendek dari kabel terputus yang digunakan dalam percobaan elektrokimia.[4] Baterai timbal-asam didasarkan pada dua elektroda timbal, setidaknya satu di antaranya sebagian teroksidasi menjadi timbal oksida (PbO2), dipisahkan oleh elektrolit yang mengandung asam sulfat. Selama pelepasan, oksidasi terjadi di elektroda timbal (anoda), menghasilkan elektron, proton, dan timbal sulfat (PbSO4), sedangkan oksida timbal direduksi menjadi PbSO4 di katoda. Dalam hal ini, tegangan sel sekitar 2 V, dan aki mobil 12-V di mana terdiri dari enam sel yang terhubung secara seri.
Tonggak penting lain dalam pengembangan baterai terjadi pada tahun 1899, ketika Waldemar Jungner menggambarkan baterai nikel-besi (Ni-Fe) dan nikel-kadmium (Ni-Cd) pertama.[5] Tidak lama kemudian, Thomas A. Edison juga menggambarkan baterai tersebut.[6] Baterai alkaline ini menjadi pendahulu baterai nikel-logam hidrida (Ni-MH), yang dikomersialkan pada tahun 1989.
Halaman
DAFTAR PUSTAKA
- ^ Volta, A. 1800. On the Electricity Excited by the Mere Contact of Conducting Substances of Different Kinds. Philos. Trans. Royal Soc. 90, 403–431.
- a, b Placke, T.; Kloepsch, R.; Dühnen, S.; Winter, M. 2017. Lithium Ion, Lithium Metal, and Alternative Rechargeable Battery Technologies: The Odyssey for High Energy Density. J. Solid State Electrochem. 21 (7), 1939–1964.
- ^ Munro, J. 1890. Pioneers of Electricity; or, Short Lives of the Great Electricians; London: The Religious Tract Society.
- ^ Gautherot, N. 1801. Sur le galvanisme. Ann. Chim. 39, 203–210.
- ^ Jungner, E. W. 1901. Sätt att på elektrolytisk väg förstora ytan af sådana metaller, hvilkas syreföreningar äro kemiskt olösliga i alkaliska lösningar. Swedish patent no. 15567,
- ^ Edison, T. A. 1902. Reversible Galvanic Battery. US patent no. 692,507.
- ^ Arfwedson, J. A. 1818. Untersuchung einiger bei der Eisen-Grube von Utö vorkommenden Fossilien und von einem darin gefundenen neuen feuerfesten Alkali. J. Chem. Phys. 22, 93–117.
- ^ Lewis, G. N.; Keyes, F. G. 1913. The Potential of the Lithium Electrode. J. Am. Chem. Soc, 35, 340–344.
- ^ Harris, W. S. 1958. Electrochemical Studies in Cyclic Esters; PhD thesis, University of California, Berkeley.
- ^ Yao, Y.-F. Y.; Kummer, J. T. 1967. Ion Exchange Properties of and Rates of Ionic Diffusion in Beta-Alumina. J. Inorg. Nucl. Chem. 29 (9), 2453–2475.
- ^ Kummer, J. T.; Neill, W. 1969. Thermo-Electric Generator. US patent No. 3,458,356.
- ^ Newman, J. 1967. Transport in Electrolytic Solutions. Adv. Electrochem. Electrochem. Eng, 5, 87–135.
- ^ Whittingham, M. S. 1978. Chemistry of Intercalation Compounds: Metal Guests in Chalcogenide Hosts. Prog. Solid State Chem, 12 (1), 41–99.
- ^ Rüdorff, W. 1965. Chimia, 19, 489.
- ^ Bichon, J.; Danot, M.; Rouxel, J. 1973. Systematique Structurale Pour Les Series d’intercalaires Mxtis2 (M= Li, Na, K, Rb, Cs). Comptes Rendus Acad. Sci., Ser. C, Sci. Chim, 276, 1283 – 1286.
- ^ Whittingham, M. S.; Gamble, F. R. 1975. The Lithium Intercalates of the Transition Metal Dichalcogenides. Mater. Res. Bull, 10 (5), 363–371.
- ^ Whittingham, M. S. 1974. Electrointercalation in Transition-Metal Disulphides. J. Chem. Soc., Chem. Commun, 328–329.
- ^ Whittingham, M. S. 1975. Batterie à Base de Chalcogénures. Belgian patent no. 819672.
- ^ Whittingham, M. S. 2012. History, Evolution, and Future Status of Energy Storage. Proc. IEEE, 100, 1518–1534.
- ^ Goodenough, J. B.; Mizushima, K. 1982. Fast Ion Conductors. US patent no. 4,357,215.
- ^ Yoshino, A.; Sanechika, K.; Nakajima, T. 1987. Secondary Battery. US patent no. 4,668,595, May 26.











Komentar berhasil disembunyikan.