Hallo sobat100,
It's Science Time, kali ini tim100 akan memberikan informasi terbaru dari bidang Sains. Tanggal 1-8 Oktober 2018 akan diumumkan para peraih Hadiah Nobel tahun 2018 di bidang Sains. Siapa sajakah mereka? Apa saja yang ditemukan? Berikut Informasinya untuk sobat100.
Sobat100, Pengumuman Pemenang Hadiah Nobel dan Penerima Penghargaan dalam Ilmu Sains untuk tahun ini dimulai pada Senin (1 Oktober 2018). Pemberian penghargaan Hadiah Nobel diberikan kepada nama-nama yang direkomendasikan oleh Komite Nobel masing-masing. Setelah pemungutan suara, konferensi pers diadakan oleh Komite Hadiah Nobel.
Pengumuman Hadiah Nobel 2018

Komite sudah bekerja dengan hati-hati dan independen untuk memilih penerima Hadiah Nobel 2018 dan Hadiah Sveriges Riksbank dalam Ilmu Ekonomi dalam Memori Alfred Nobel. Para pemenang hadiah akan diumumkan mulai 1 Oktober 2018, mengungkapkan para ilmuwan dan pekerja perdamaian yang sesuai dengan visi Alfred Nobel , yaitu telah memberikan manfaat terbesar bagi umat manusia.
Akademi Swedia telah memutuskan untuk menunda Hadiah Nobel 2018 dalam Sastra, dengan maksud akan memberikannya pada 2019. Semua pengumuman akan disiarkan langsung di situs resmi Nobelprize.org.
Pengumuman keputusan pemenang nobel 2018 sebagai berikut:
1. Senin 1 Oktober, Hadiah Nobel dalam Fisiologi atau Kedokteran
2. Selasa 2 Oktober, Hadiah Nobel dalam Fisika
3. Rabu 3 Oktober, Hadiah Nobel Kimia
4. Jumat 5 Oktober, Hadiah Nobel Perdamaian
5. Senin 8 Oktober, The Sveriges Riksbank Prize dalam Ilmu Ekonomi dalam Memori Alfred Nobel
Pemenang Nobel dalam Fisiologi atau Kedokteran 2018
Majelis Nobel di Karolinska Institutet memutuskan untuk memberi penghargaan Hadiah Nobel 2018 dibidang Fisiologi atau Kedokteran kepada James P. Allison dan Tasuku Honjo. Atas penemuan mereka mengenai terapi kanker mereka dengan penghambatan regulasi kekebalan negatif, Senin (1 Oktober 2018) pukul 16.30 WIB (atau jam 11 waktu setempat).

(James P. Allison)

(Tasuku Honjo)
Latar Belakang

Kanker membunuh jutaan orang setiap tahun dan merupakan salah satu tantangan kesehatan terbesar manusia. Dengan merangsang kemampuan yang melekat pada sistem kekebalan tubuh kita untuk menyerang sel-sel tumor. Nobel tahun ini telah menetapkan prinsip yang sama sekali baru untuk terapi kanker.
Menurut WHO, lebih dari 18 juta orang di dunia diperkirakan didiagnosis kanker pada 2018.[1] Hari ini, di negara-negara yang secara ekonomi lebih maju satu dari tiga orang diduga telah mengidap kanker dan diperkirakan menjadi satu dari dua orang dalam dua dekade. Jumlahnya terus meningkat selama 50 tahun terakhir. Dalam periode yang sama perbandingan pasien yang sembuh (seperti yang diperkirakan kelangsungan hidup lima tahun) telah meningkat dari kurang dari sepertiga menjadi lebih dari dua pertiga. Hal ini menyatakan angka rata-rata yang menjadi perbedaan utama antara kanker di organ yang berbeda dengan bentuk penyakit sebelumnya dan lebih maju pada organ penyakit yang sama di berbagai negara. Terjadinya metastasis sering menyiratkan bahwa tidak mungkin untuk menyembuhkan penyakit, bahkan jika hidup dapat diperpanjang oleh perawatan yang berbeda. Di negara-negara dengan ekonomi yang kurang berkembang, proporsi pasien yang lebih rendah didiagnosis dan diobati, menghasilkan lebih sedikit obat dan mengurangi kelangsungan rata-rata hidup.
Dapatkah pertahanan kekebalan tubuh kita dilibatkan untuk pengobatan kanker?
Kanker terdiri dari banyak penyakit yang berbeda, semuanya ditandai penyebaran yang tidak terkontrol sel-sel abnormal dengan kapasitas untuk menyebar ke organ dan jaringan sehat. Sejumlah terapi pendekatan tersedia untuk pengobatan kanker, termasuk operasi, radiasi, dan strategi lainnya, beberapa di antaranya telah dianugerahi Hadiah Nobel sebelumnya. Contohnya, metode untuk pengobatan hormon untuk kanker prostat (Huggins, 1966), kemoterapi (Elion dan Hitchins, 1988), dan transplantasi sumsum tulang untuk leukemia (Thomas 1990). Namun, kanker masih sangat sulit diobati, dan strategi terapi baru sangat sulit diterapkan.
Pada akhir abad ke-19 dan awal abad ke-20 konsep yang muncul bahwa pengaktifan sistem kekebalan tubuh mungkin merupakan strategi untuk menyerang sel-sel tumor. Upaya dilakukan untuk menginfeksi pasien dengan bakteri untuk mengaktifkan pertahanan. Upaya ini hanya memiliki efek sederhana, tetapi berbeda dari strategi yang digunakan saat ini dalam pengobatan kanker kandung kemih. Menyadari itu dibutuhkan lebih banyak pengetahuan. Banyak ilmuwan yang terlibat dalam penelitian dasar yang hebat dan menemukan mekanisme mendasar yang mengatur kekebalan dan juga menunjukkan bagaimana kekebalan tubuh sistem dapat mengenali sel kanker. Meskipun kemajuan ilmiah luar biasa, upaya untuk mengembangkan strategi baru yang dapat digeneralisasikan untuk melawan kanker terbukti sulit.
Aktivasi Sel T dan Konsep Kostimulasi
Sel T telah berada di tahap utama dalam ilmu pengetahuan kekebalan tubuh, tetapi hingga tahun 1980-an, bagaimana reseptor antigen bisa mengenali reseptor masih sulit dimengerti, sedangkan reseptor spesifik-antigen dalam sel B ditandai dengan baik. Dengan demikian, selama perbedaan mereka, sel B diketahui untuk mengatur ulang gen immunoglobulin (Hadiah Nobel untuk Susumu Tonegawa pada tahun 1987), menyatakan protein imunoglobulin yang dihasilkan di permukaan mereka dan mengeluarkan sejumlah besar ke dalam cairan tubuh. Pada tahun 1975 perkembangan teknologi antibodi monoklonal oleh George J F Köhler dan César Milstein, di mana mereka dianugerahi Hadiah Nobel pada tahun 1984, membuka jalan untuk identifikasi penanda permukaan sel baru. Teknologi ini menjadi penting, tidak hanya untuk mengidentifikasi molekul kunci pada sel T, tetapi juga untuk yang pengobatan baru dipenghargaan Hadiah Nobel tahun ini. Perkembangan utama untuk memahami respon imun adaptif seluler terjadi pada tahun 1980-an. Selama dekade ini, reseptor sel T (TCR) diidentifikasi dan interaksinya dengan peptida terkait MHC pada antigen-presenting sel-sel terungkap.
Gen untuk interleukin-2, pengatur penting sel T, dikloning dan cara kerjanya yang mendasari pemberian isyarat TCR mulai dipahami. Menjadi jelas bahwa interaksi antara antigen TCR dan MHC tidak cukup untuk aktivasi sel T, yang mengarah ke konsep Kostimulasi. Penguraian mekanisme yang mendasari adalah proses tambahan yang terjadi selama tahun 1980-an dan 1990-an yang melibatkan banyak laboratorium di seluruh dunia. Molekul permukaan sel pertama yang diidentifikasi dalam kostimulasi TCR adalah CD28, yang pada awalnya ditemukan oleh antibodi monoklonal mengenali 4 protein ini pada sel T dan thymocytes.[2] CD28 ditemukan bersinergi dengan kompleks TCR dalam aktivasi sel T.[3] Empat tahun kemudian ligan untuk CD28 diidentifikasi sebagai molekul B7 (sekarang dikenal sebagai CD80), yang diekspresikan pada antigen-presentingcells.[4] Lieping Chen, Peter Linsley dan rekan kerja[5] menyarankan peran untuk kostimulasi dalam imunologi tumor dengan menunjukkan bahwa transfer gen B7 ke sel tumor menyebabkan penolakan, seperti yang ditunjukkan juga oleh kelompok James P. Allison.[6]
Akselerator dan Rem di Sistem Kekebalan Kita
Ciri mendasar dari sistem kekebalan kita adalah kemampuan untuk membedakan "diri" dari "bukan-diri" sehingga menyerang bakteri, virus, dan bahaya lainnya dapat diserang dan dihilangkan. T sel, sejenis sel darah putih, adalah kunci pemain dalam pertahanan ini.
Sel T terbukti memiliki reseptor yang mengikat struktur yang dikenal sebagai "bukan-diri" dan interaksi tersebut memicu sistem kekebalan untuk terlibat dalam pertahanan. Tetapi protein tambahan yang bertindak sebagai akselerator sel T juga diperlukan untuk memicu respon kekebalan tubuh. Banyak ilmuwan berkontribusi untuk penelitian dasar yang penting ini dan mengidentifikasi protein lain yang berfungsi sebagai rem pada sel T, menghambat aktivasi kekebalan. Keseimbangan yang rumit antara akselerator dan rem ini penting untuk kontrol. Ini memastikan bahwa sistem kekebalan tubuh cukup terlibat dalam serangan terhadap mikroorganisme asing sambil menghindari aktivasi berlebihan yang dapat menyebabkan kerusakan autoimun sel dan jaringan sehat.
Banyak ilmuwan berkontribusi untuk penelitian dasar yang penting ini dan mengidentifikasi protein lain yang berfungsi sebagai rem pada sel T, menghambat aktivasi kekebalan. Keseimbangan yang rumit antara akselerator dan rem ini penting untuk kontrol yang ketat. Ini memastikan bahwa sistem kekebalan tubuh cukup terlibat dalam serangan terhadap mikroorganisme asing sambil menghindari aktivasi berlebihan yang dapat menyebabkan kerusakan autoimun sel dan jaringan sehat. Allison dan Honjo menunjukkan bagaimana strategi yang berbeda untuk menghambat rem pada sistem kekebalan tubuh dapat digunakan dalam pengobatan kanker. Penemuan seminal oleh kedua pemenang penghargaan merupakan peristiwa penting dalam perjuangan kita melawan kanker.
Sebuah Prinsip Baru Untuk Terapi Imun
Allison Dengan Teknik Anti CTLA4
James P. Allison mempelajari protein yang dikenal yang berfungsi sebagai rem pada sistem kekebalan tubuh. Dia menyadari kemampuan melepaskan rem dan dengan demikian melepaskan sel kekebalan kita untuk menyerang tumor. Dia kemudian mengembangkan konsep ini menjadi pendekatan baru untuk mengobati pasien.
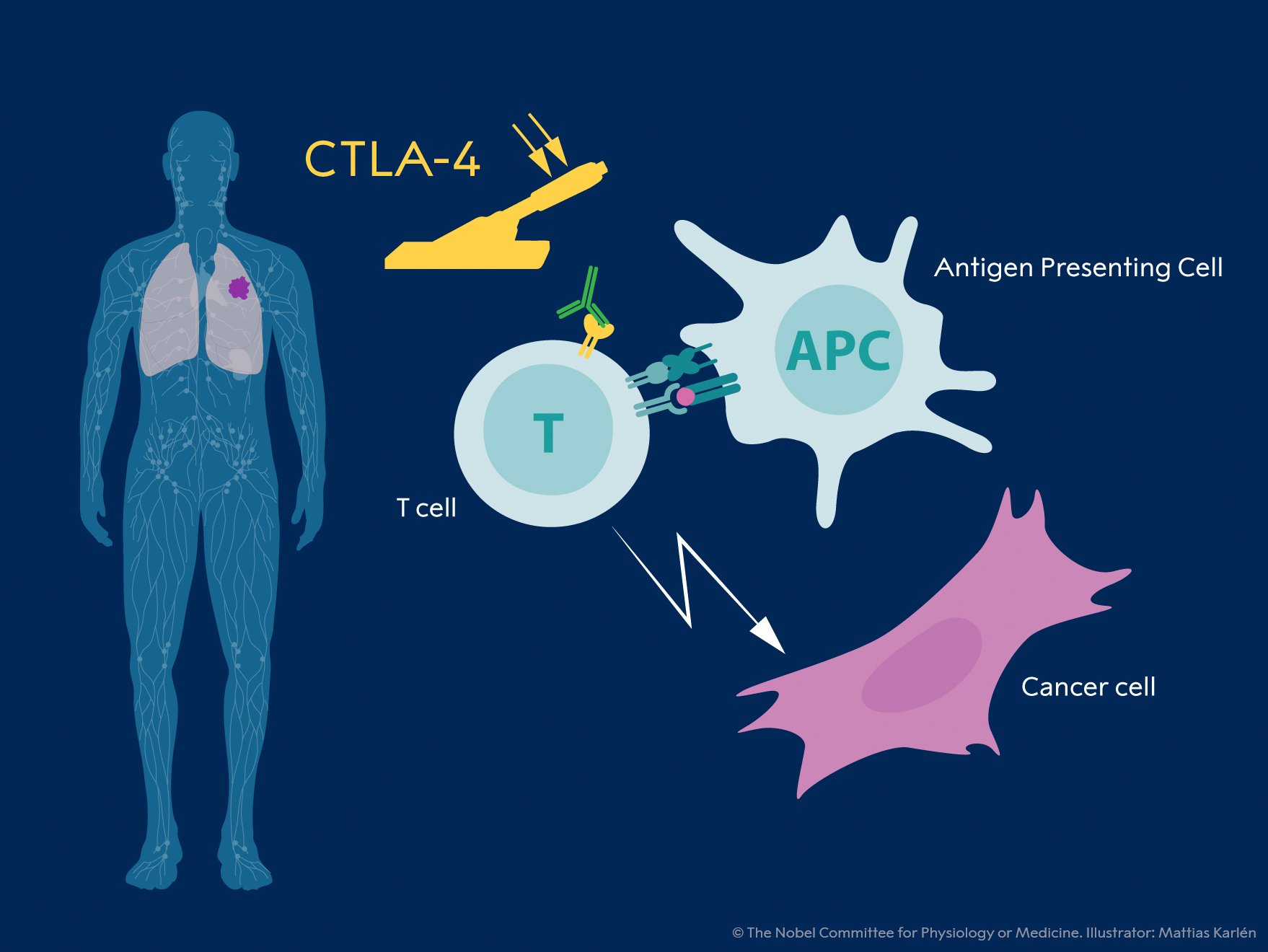
Selama 1990-an, di laboratoriumnya di Universitas California, Berkeley, James P. Allison mempelajari protein T-sel CTLA-4. Dia adalah salah satu dari beberapa ilmuwan yang telah membuat pengamatan bahwa CTLA-4 berfungsi sebagai rem pada sel T. Tim peneliti lain mengeksploitasi mekanisme sebagai target dalam pengobatan penyakit autoimun. Namun, Allison memiliki gagasan yang sama sekali berbeda. Dia sudah mengembangkan antibodi yang dapat mengikat CTLA-4 dan memblokir fungsinya (Lihat Gambar 1).
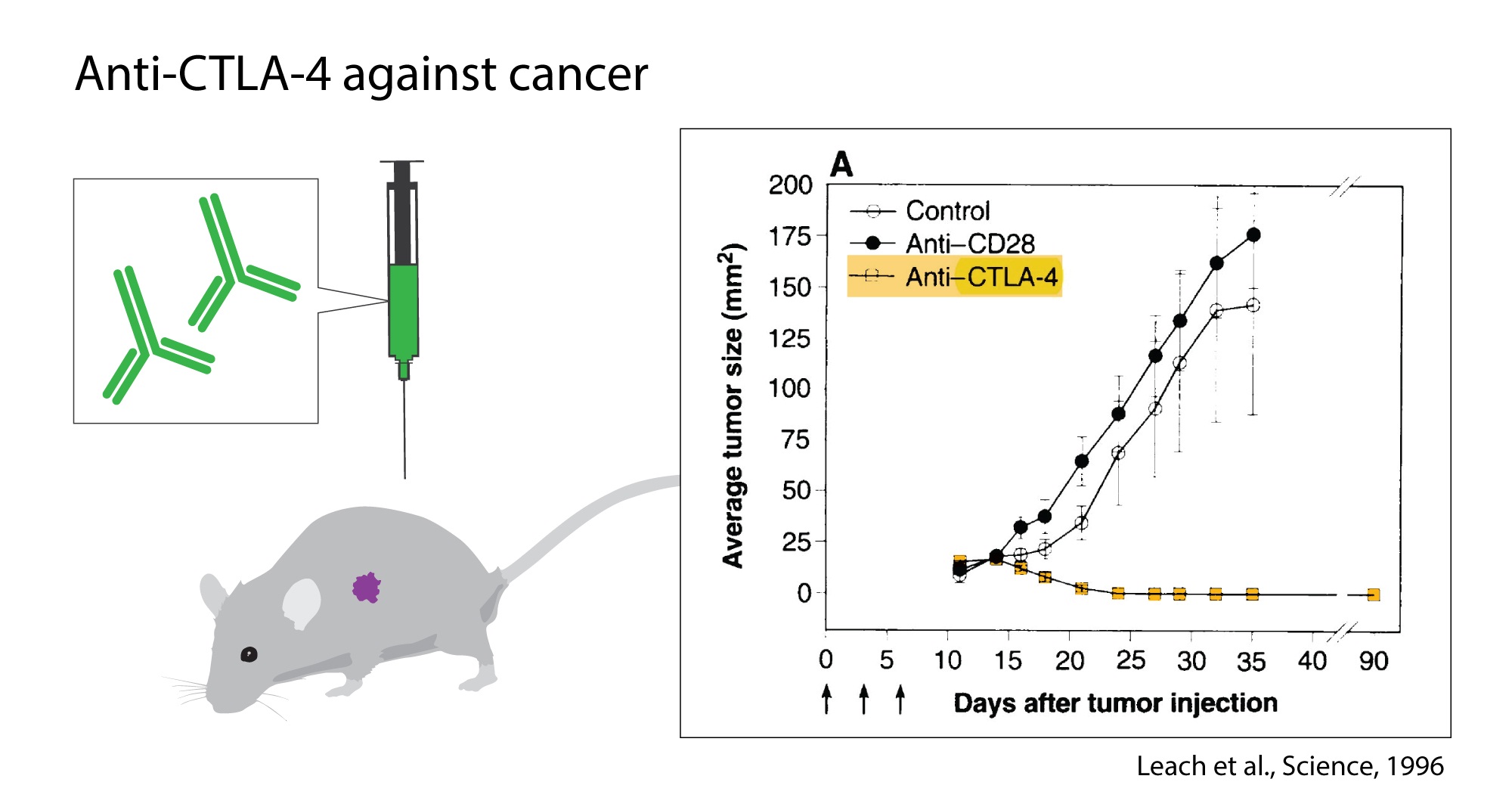
Gambar 1. Penemuan James P. Allison dan rekan kerja, memanfaatkan peran CTLA-4 sebagai inhibitor aktivasi dan mengembangkan antibodi untuk melepaskan rem. Grafik ini menunjukkan efek pengobatan anti-CTLA-4 pada tikus pembawa tumor dibandingkan dengan kontrol.
Dia sekarang mulai untuk menyelidiki apakah CTLA-4 blokade dapat melepaskan rem sel-T dan melepaskan sistem kekebalan untuk menyerang sel-sel kanker. Allison dan rekan kerja melakukan percobaan pertama pada akhir 1994, hasilnya spektakuler. Tikus dengan kanker telah disembuhkan dengan pengobatan dengan antibodi yang menghambat rem dan membuka aktivitas Tcell antitumor. Meskipun sedikit tertarik dengan industri farmasi, Allison melanjutkan upaya mendasarnya untuk mengembangkan strategi menjadi terapi bagi manusia. Hasil yang menjanjikan segera muncul beberapa kelompok, dan pada tahun 2010 sebuah penelitian yang penting menunjukkan efek mencolok pada pasien dengan melanoma lanjut, sejenis kanker kulit. Pada beberapa pasien tanda-tanda kanker yang tersisa menghilang. Hasil luar biasa seperti itu belum pernah terlihat sebelumnya pada kelompok pasien ini.
Tasuku Honjo Dengan Penemuan PD-1 dan Pentingnya Terapi Kanker
Secara paralel, Tasuku Honjo menemukan protein pada sel kekebalan tubuh dan, setelah eksplorasi hati-hati fungsinya, akhirnya terungkap bahwa itu juga beroperasi sebagai rem, tetapi dengan mekanisme yang berbeda aksi. Terapi berdasarkan penemuannya terbukti sangat efektif dalam melawan kanker.
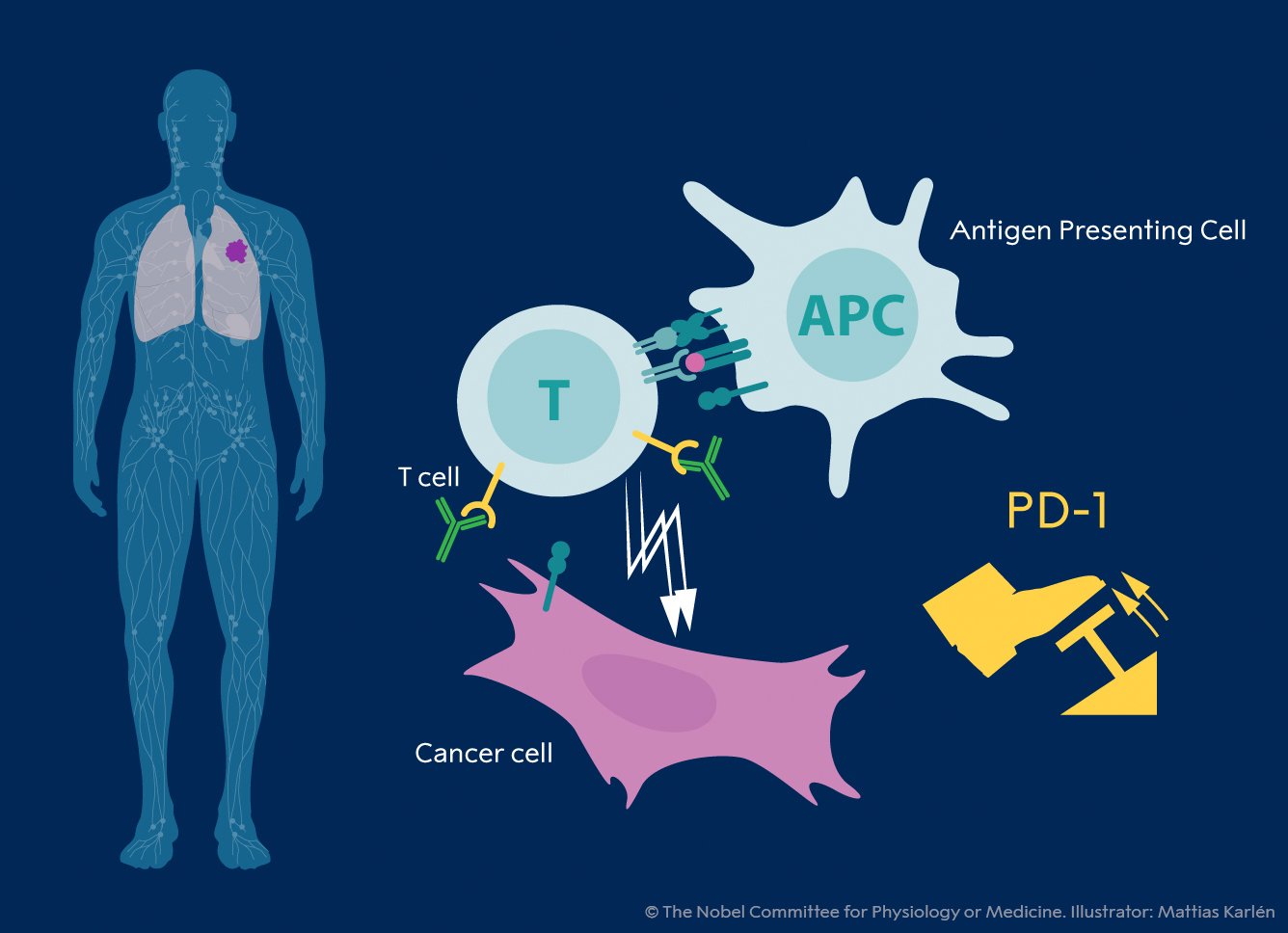
Pada tahun 1992, beberapa tahun sebelum penemuan Allison, Tasuku Honjo menemukan PD-1, protein lain dilakukan di permukaan sel-T.[7] Bertekad untuk mengungkap perannya, ia dengan teliti mengeksplorasi berfungsi dalam serangkaian eksperimen yang dilakukan selama bertahun-tahun di laboratoriumnya di Universitas Kyoto. Hasilnya menunjukkan bahwa PD-1, mirip dengan CTLA-4, berfungsi sebagai rem sel T, tetapi beroperasi dengan mekanisme yang berbeda (Lihat Gambar 2).
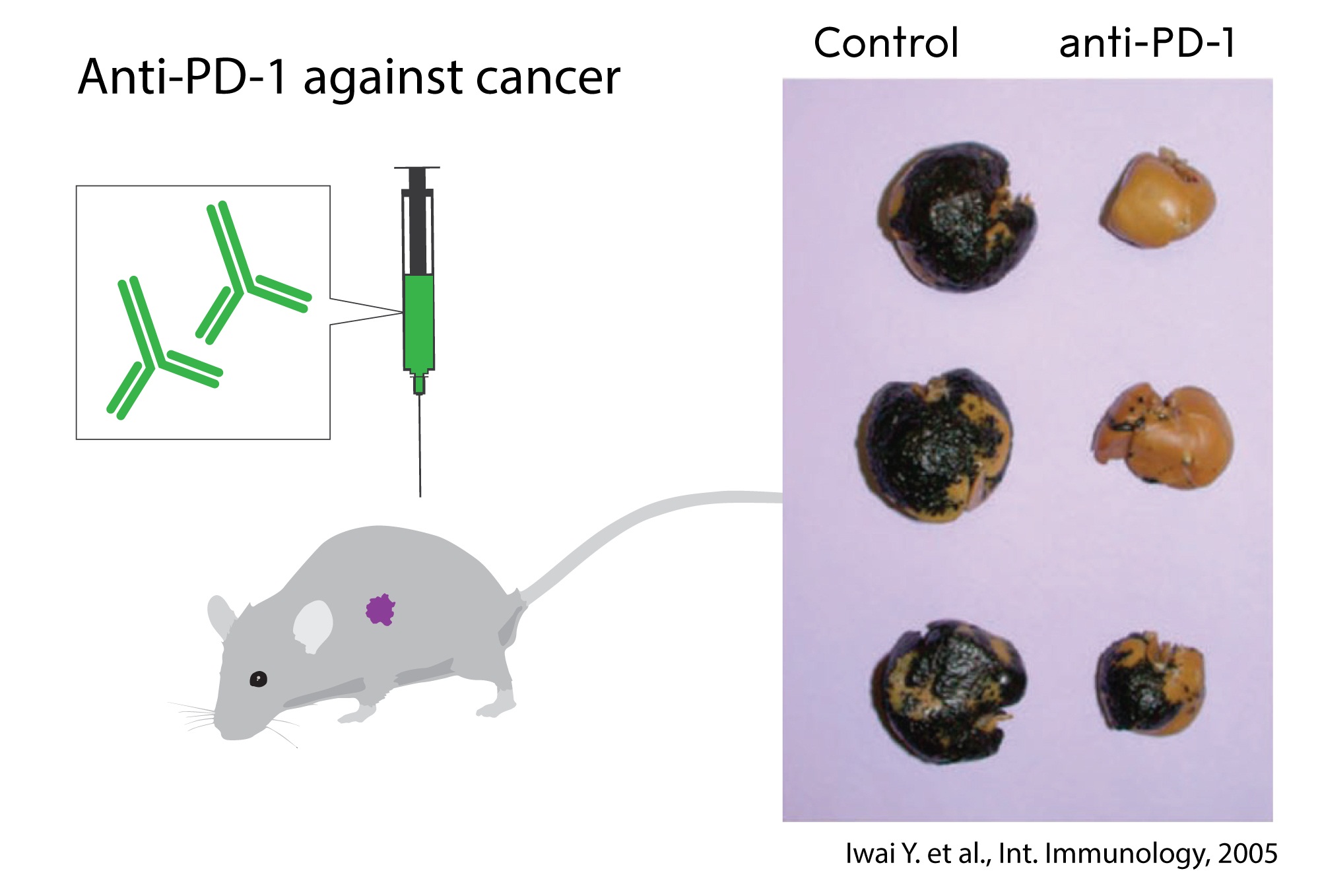
Gambar 2. Penemuan oleh Tasuku Honjo dan rekan kerja, identifikasi protein permukaan PD-1, mengakui perannya sebagai inhibitor aktivasi dan mengembangkan antibodi untuk melepaskan rem. Grafik menunjukkan efek pengobatan anti-PD-1 pada tikus dengan melanoma bermetastasis dibandingkan dengan kontrol yang tidak diobati.[8]
Dalam percobaan pada hewan, blokade PD-1 juga terbukti menjadi strategi yang menjanjikan dalam perang melawan kanker, seperti yang ditunjukkan oleh Honjo dan kelompok lain. Ini membuka jalan untuk memanfaatkan PD-1 sebagai target dalam pengobatan pasien. Perkembangan terjadi, dan pada tahun 2012 sebuah uji klinis menunjukkan kunci efikasi yang jelas dalam pengobatan pasien dengan berbagai jenis kanker. Hasilnya luarbisa, yang mengarah ke remisi jangka panjang dan penyembuhan yang mungkin pada beberapa pasien dengan kanker metastatik, suatu kondisi yang sebelumnya dianggap pada dasarnya tidak dapat diobati.
Terapi Imun Pos Kekebalan untuk Kanker Saat Ini dan di Masa Depan
Setelah pelajaran di awal menunjukkan efek CTLA-4 dan blokade PD-1, perkembangan klinisnya sangat dramatis. Kita sekarang tahu bahwa perawatan, sering disebut sebagai "Terapi Imun Pos Kekebalanâ€, secara mendasar mengubah hasil untuk kelompok pasien tertentu dengan kanker stadium lanjut. Mirip dengan terapi kanker lainnya, efek samping yang merugikan terlihat, yang bisa serius dan bahkan mengancam jiwa. Hal ini disebabkan oleh respon imun yang terlalu aktif yang menyebabkan reaksi autoimun, tetapi biasanya dapat ditangani. Penelitian berkelanjutan yang intens difokuskan pada menjelaskan cara kerjanya, dengan tujuan meningkatkan terapi dan mengurangi efek samping (Lihat Gambar 3).
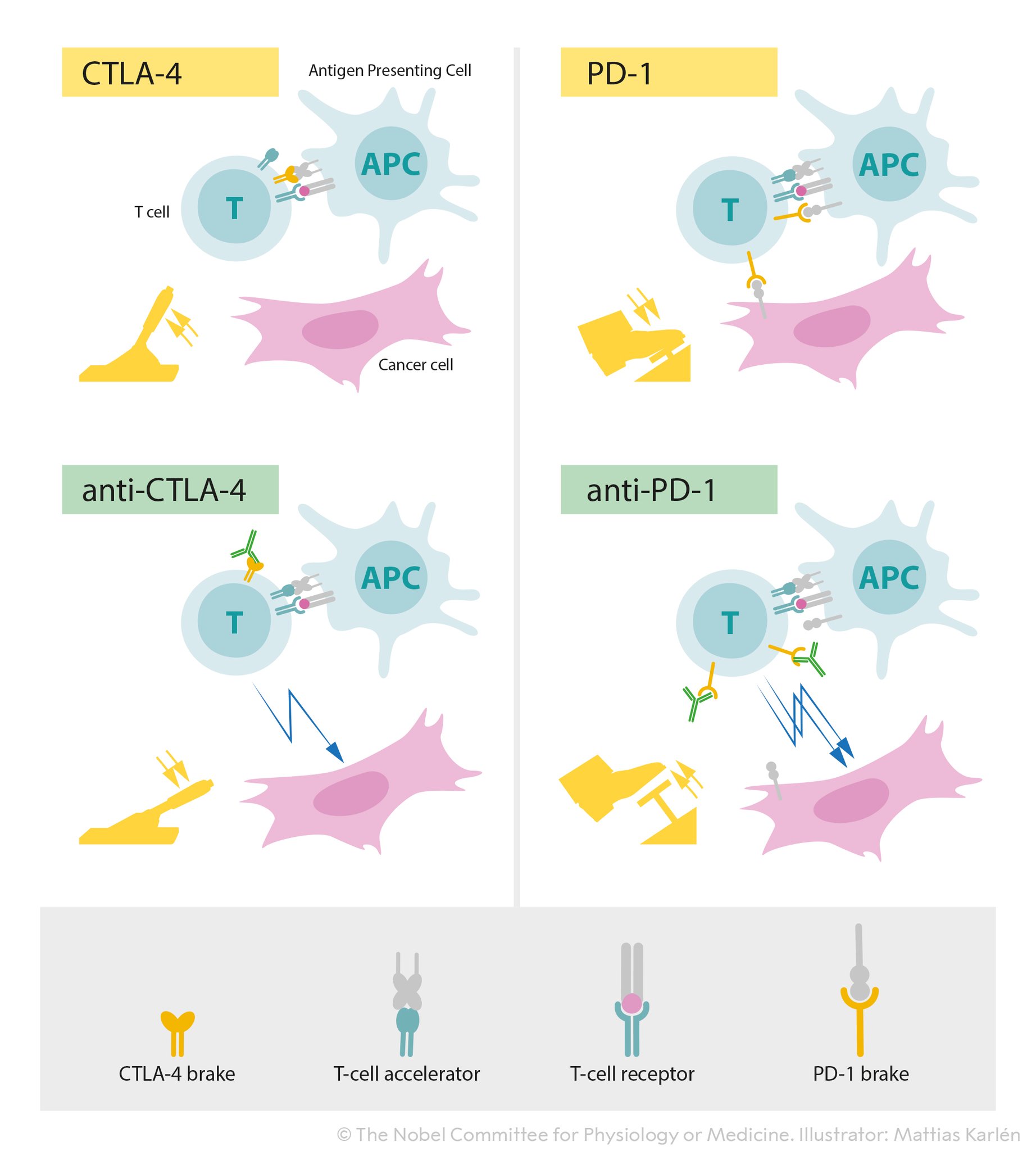
Gambar 3. Kiri atas: Aktivasi sel T mengharuskan reseptor sel-T berikatan dengan struktur yang lain sel-sel kekebalan yang dikenal sebagai "non-diri". Sebuah protein berfungsi sebagai akselerator sel T juga diperlukan untuk T aktivasi sel. CTLA-4 berfungsi sebagai rem pada sel T yang menghambat fungsi akselerator.
Kiri Bawah: Antibodi (hijau) terhadap CTLA-4 memblokir fungsi rem yang menyebabkan aktivasi sel T dan menyerang sel kanker. Kanan atas: PD-1 adalah rem sel-T lain yang menghambat aktivasi sel-T. Kanan bawah: Antibodi melawan PD-1 menghambat fungsi rem yang menyebabkan aktivasi sel T dan serangan yang sangat efisien pada kanker
Dari dua strategi pengobatan, terapi pos pemeriksaan terhadap PD-1 telah terbukti lebih efektif dan hasil positif diamati dalam beberapa jenis kanker, termasuk kanker paru-paru, kanker ginjal, limfoma dan melanoma. Uji klinis baru menunjukkan bahwa terapi kombinasi, menargetkan CTLA-4 dan PD-1, dapat menjadi lebih efektif, seperti yang ditunjukkan pada pasien dengan melanoma. Dengan demikian, Allison dan Honjo telah mendapatkan cara untuk menggabungkan berbagai strategi untuk melepaskan rem pada sistem kekebalan tubuh dengan tujuan menghilangkan sel tumor bahkan lebih efisien. Sejumlah uji coba yang besar, terapi pos pemeriksaan saat ini sedang dilakukan terhadap sebagian besar jenis kanker, dan protein pos pemeriksaan baru sedang diuji sebagai target (Lihat Gambar 4).
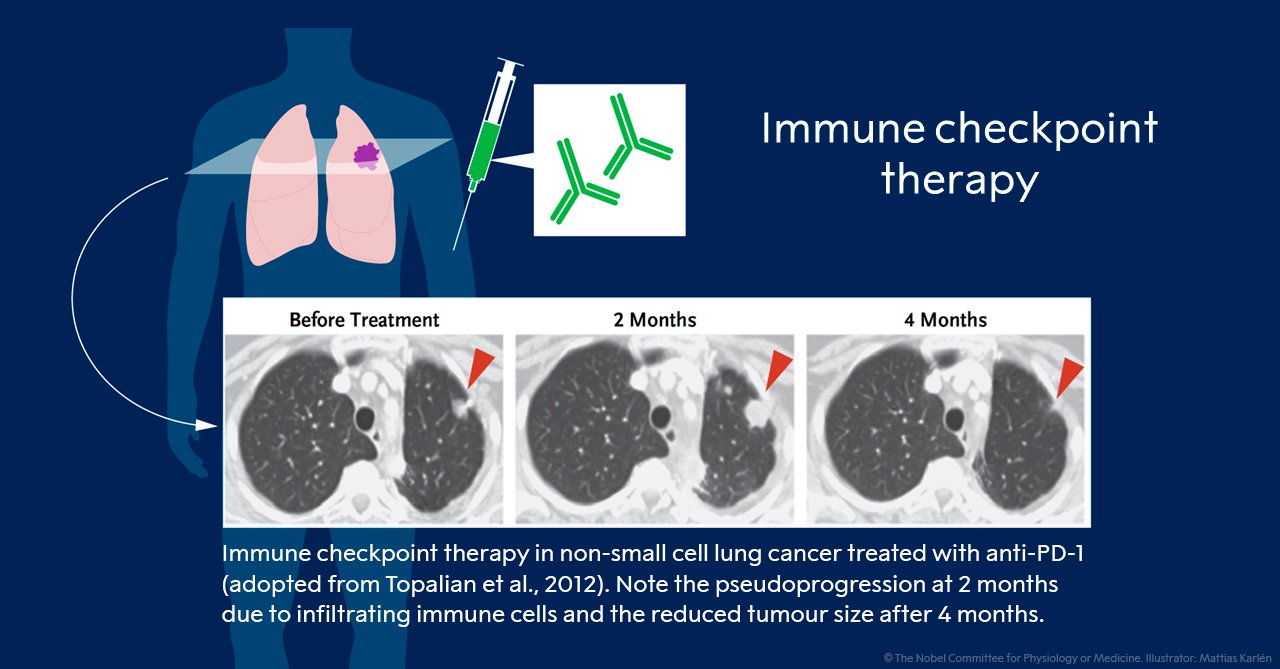
Gambar 4. Terapi imun pos pemeriksaan pada kanker paru-paru sel non-kecil yang diobati dengan anti-PD-1. Harap dicatat pseudoprogression pada 2 bulan karena sel-sel kekebalan masuk dan ukuran tumor berkurang setelah 4 bulan.[9]
Selama lebih dari 100 tahun, para ilmuwan berusaha untuk melibatkan sistem kekebalan dalam perang melawan kanker. Sampai penemuan-penemuan seminal oleh kedua pemenang, kemajuan dalam pengembangan klinis adalah sederhana. Terapi titik pemeriksaan kini telah merevolusi pengobatan kanker dan secara mendasar telah mengubah cara pandang kita bagaimana kanker dapat dikelola.
James P. Allison

Profile
James P. Allison lahir 7 Agustus 1948 adalah seorang profesor imunolog Amerika yang memiliki jabatan sebagai ketua Imunologi dan direktur eksekutif dari platform imunoterapi di Pusat Kanker M. D. Anderson. Penemuannya telah menyebabkan perawatan kanker baru untuk kanker paling mematikan. Dia juga direktur dewan penasihat ilmiah Lembaga Penelitian Kanker (CRI). Dia memiliki minat yang lama dalam mekanisme pengembangan dan aktivasi sel-T, pengembangan strategi baru untuk imunoterapi tumor, dan diakui sebagai orang pertama yang menggunakan protein kompleks reseptor antigen sel-T. Pada tahun 2014 dan 2018, ia memenangkan Hadiah Tang dalam Ilmu Biofarmasi dan Hadiah Nobel dalam Fisiologi atau Kedokteran bersama dengan Tasuku Honjo.
Masa Muda
James Allison lahir pada 7 Agustus 1948 sebagai bungsu dari tiga bersaudara menjadi Albert dan Constance Allison. Dia terinspirasi oleh guru matematika kelas 8 untuk mengejar karir di bidang sains. Allison meraih gelar B.S. dalam mikrobiologi pada tahun 1969 di mana ia menjadi anggota persaudaraan Delta Kappa Epsilon. Ia meraih gelar Ph.D. dalam ilmu biologi, pada tahun 1973, dari Universitas Texas, Austin sebagai murid G. Barrie Kitto.
Karier
Ia diangkat sebagai profesor imunologi dan direktur Laboratorium Penelitian Kanker di Universitas California, Berkeley pada 1985. Pada tahun 2004, ia pindah ke Pusat Kanker Memorial Sloan-Kettering (MSKCC) di New York City untuk menjadi direktur Ludwig Center for Cancer Immunotherapy dan ketua program imunologi serta ketua Koch dalam studi imunologi dan menghadiri imunologi di Pusat Kanker Memorial Sloan-Kettering. Ia juga seorang penyelidik Howard Hughes Medical Institute (HHMI) hingga 2012, ketika ia pergi untuk bergabung dengan Pusat Kanker M. D. Anderson pada 2012. Sejak 2012 ia telah menjadi ketua imunologi di M.D. Anderson. Dia adalah anggota National Academy of Sciences dan Institute of Medicine, dan merupakan rekan dari Akademi Mikrobiologi Amerika dan Asosiasi Amerika untuk Kemajuan Ilmu Pengetahuan. Dia adalah direktur dewan penasihat ilmiah Cancer Research Institute. Sebelumnya, ia menjabat sebagai presiden dari American Association of Immunologists.
Penelitian
Penelitiannya untuk menjelaskan mekanisme reaksi sel T dilakukan pada akhir 1980-an di University of Texas, M. D. Anderson Cancer Center dan pada 1990-an di University of California, Berkeley. Pada awal 1990-an, Jim Allison dan Jeff Bluestone menunjukkan bahwa CTLA-4 bertindak sebagai molekul penghambat untuk membatasi tanggapan sel T. Pada tahun 1996, Allison adalah yang pertama menunjukkan bahwa blokade antibodi dari molekul penghambatan sel-T (dikenal sebagai CTLA-4) dapat menyebabkan respon kekebalan anti-tumor yang meningkat dan penolakan tumor.[10] Konsep ini memblokir jalur penghambatan sel-T sebagai cara melepaskan tanggapan kekebalan anti-tumor dan memunculkan manfaat klinis yang meletakkan dasar untuk pengembangan obat lain yang menargetkan jalur penghambatan sel-T, yang telah diberi label sebagai "terapi pos pemeriksaan kekebalan". Pekerjaan ini akhirnya mengarah pada pengembangan klinis ipilimumab (Yervoy ™), yang disetujui pada tahun 2011 oleh FDA untuk pengobatan melanoma metastatik.
Penelitian Allison adalah imunologi molekuler dari reseptor antigen sel T reseptor, reseptor ko-stimulasi, dan molekul lain yang terlibat dalam aktivasi sel T. Dia sangat tertarik untuk mencari sinyal yang mengarah pada diferensiasi sel T naif dan juga mereka yang menentukan apakah keterlibatan reseptor antigen akan mengarah pada aktivasi fungsional atau inaktivasi sel T. Setelah didefinisikan, pelajaran dasar digunakan untuk mengembangkan strategi baru untuk pengobatan penyakit autoimun dan imunoterapi kanker. Baru-baru ini dia tertarik untuk memahami tanggapan kekebalan pada pasien kanker yang merespon imunoterapi. Ia mendirikan platform imunoterapi di MD Anderson Cancer Center untuk mempelajari tanggapan kekebalan pada pasien kanker.
Tasuku Honjo

Biografi
Tasuku Honjo lahir 27 Januari 1942 di Kyoto, seorang imunolog Jepang, terkenal karena identifikasi Programmed Cell Death Protein 1 (PD-1). Ia juga dikenal karena identifikasi molekulernya dari sitokin: IL-4 dan IL-5, serta penemuan Aktivasi Cytidine Deaminase (ACD) yang diaktivasi yang sangat penting untuk kelas rekombinasi saklar dan hypermutation somatik. Honjo menyelesaikan gelar M.D. pada tahun 1966 dari Fakultas Kedokteran, Universitas Kyoto, di mana pada tahun 1975 ia menerima gelar Ph.D. dalam Kimia Medis di bawah pengawasan Yasutomi Nishizuka dan Osamu Hayaishi.
Dari tahun 1971 hingga 1974, ia melayani sebagai rekan tamu di Departemen Embriologi, Institusi Carnegie di Washington dan di Institut Nasional Kesehatan Anak dan Pembangunan Manusia, Institut Kesehatan Nasional. Setelah belajar di AS, ia adalah asisten profesor di Fakultas Kedokteran, Universitas Tokyo antara 1974 dan 1979, dan menjabat sebagai Profesor dan Ketua Departemen Genetika, School of Medicine, Universitas Osaka antara 1979 dan 1984.
Kontribusi
Honjo telah menetapkan konsep kerja dasar dari rekombinasi saklar kelas. Dia mempresentasikan model yang menjelaskan penyusunan ulang gen antibodi dalam saklar kelas dan, antara tahun 1980 dan 1982, memverifikasi keabsahannya dengan menjelaskan struktur DNA-nya. Dia berhasil dalam cDNA clonings IL-4 dan IL-5 sitokin yang terlibat dalam switching kelas dan rantai alpha reseptor IL-2 pada tahun 1986, dan berlanjut lebih lanjut untuk menemukan AID pada tahun 2000, menunjukkan pentingnya di kelas beralih rekombinasi dan hypermutation somatik.[11]
Penghargaan
Honjo telah menerima beberapa penghargaan dan kehormatan dalam hidupnya. Pada tahun 2016, ia memenangkan Hadiah Kyoto dalam Ilmu Dasar untuk "Penemuan Mekanisme Bertanggung Jawab untuk Diversifikasi Fungsional Antibodi, Molekul Immunoregulatori dan Aplikasi Klinis PD-1".
Penghargaan dan kehormatan utama lainnya yang diterima Honjo adalah:
- 1978 - Penghargaan Young Scientist, Masyarakat Biokimia Jepang
- 1981 - Noguchi Hideyo-Memorial Award untuk Kedokteran
- 1981 - Asahi Prize
- 1984 - Kihara Prize, Genetika Society of Japan
- 1984 - Penghargaan Sains Osaka
- 1988 - Hadiah Medis Takeda
- 1992 - Behring-Kitasato Award
- 1993 - Hadiah Uehara
- 1996 - Hadiah Kekaisaran dari Akademi Jepang
- 2000 - Person of Cultural Merit
- 2012 - Hadiah Robert Koch
- 2013 - Urutan Budaya
- 2014 - Tang Prize di Biopharmaceutical Science bersama dengan James P. Allison
- 2014 - Penghargaan William B. Coley
- 2016 - Keio Medical Science Prize
- 2016 - Penghargaan Sains Fudan-Zhongzhi
- 2016 - Thomson Reuters Citation Laureates
- 2017 - Hadiah Yayasan Warren Alpert
- 2018 - Hadiah Nobel dalam Fisiologi atau Kedokteran bersama dengan James P. Allison
DAFTAR PUSTAKA :
[1] Global Cancer Observatory, 2018. http://gco.iarc.fr/
[2] Hansen JA, Martin PJ, Nowinski RC. 1980. Monoclonal antibodies identifying a novel T-cell antigen and Iaantigens on human lymphocytes. Immunogenetics. 1980, 10:247-60.
[3] Martin PJ, Ledbetter JA, Morishita Y, June CH, Beatty PG, Hansen JA. 1986. A 44 kilodalton cell surface homodimer regulates interleukin 2 production by activated human T lymphocytes. J Immunol, 136(9):3282-7.
[4] Linsley PS, Clark EA, Ledbetter JA. 1990. T-cell antigen CD28 mediates adhesion with B cells by interacting with activation antigen B7/BB-1. Proc Natl Acad Sci U S A., 87(13):5031-5.
[5] Linsley PS, Wallace PM, Johnson J, Gibson MG, Greene JL, Ledbetter JA, Singh C, Tepper MA. 1992. Immunosuppression in vivo by a soluble form of the CTLA-4 T cell activation molecule. Science, 257:792-5.
[6] Townsend SE, Allison JP. 1993. Tumor rejection after direct costimulation of CD8+ T cells by B7-transfected melanoma cells. Science, 259(5093):368-70.
[7] Ishida, Y., Agata, Y., Shibahara, K., & Honjo, T. 1992. Induced expression of PD-1, a novel member of the immunoglobulin gene superfamily, upon programmed cell death. EMBO J., 11(11), 3887–3895.
[8] Iwai, Y., Terawaki, S., & Honjo, T. 2005. PD-1 blockade inhibits hematogenous spread of poorly immunogenic tumor cells by enhanced recruitment of effector T cells. Int Immunol, 17(2), 133–144.
[9] Topalian SL, Hodi FS, Brahmer JR, Gettinger SN, Smith DC, McDermott DF, Powderly JD, Carvajal RD, Sosman JA, Atkins MB, Leming PD, Spigel DR, Antonia SJ, Horn L, Drake CG, Pardoll DM, Chen L, Sharfman WH, Anders RA, Taube JM, McMiller TL, Xu H, Korman AJ, Jure-Kunkel M, Agrawal S, McDonald D, Kollia GD, Gupta A, Wigginton JM, Sznol M. 2012. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer. N Engl J Med, 366(26):2443-54.
[10] Leach, D. R., Krummel, M. F., & Allison, J. P. 1996. Enhancement of antitumor immunity by CTLA-4 blockade. Science, 271(5256), 1734–1736.
[11] Freeman, G.J., Long, A.J., Iwai, Y., Bourque, K., Chernova, T., Nishimura, H., Fitz, L.J., Malenkovich, N., Okazaki, T., Byrne, M.C., Horton, H.F., Fouser, L., Carter, L., Ling, V., Bowman, M.R., Carreno, B.M., Collins, M., Wood, C.R. & Honjo, T. (2000). Engagement of the PD-1 immunoinhibitory receptor by a novel B7 family member leads to negative regulation of lymphocyte activation. J Exp Med, 192(7), 1027–1034.
Kwon, E. D., Hurwitz, A. A., Foster, B. A., Madias, C., Feldhaus, A. L., Greenberg, N. M., Burg, M.B. & Allison, J.P. (1997). Manipulation of T cell costimulatory and inhibitory signals for immunotherapy of prostate cancer. Proc Natl Acad Sci USA, 94(15), 8099–8103.
Nishimura, H., Nose, M., Hiai, H., Minato, N., & Honjo, T. (1999). Development of Lupus-like Autoimmune Diseases by Disruption of the PD-1 gene encoding an ITIM motif-carrying immunoreceptor. Immunity, 11, 141–151.
Hodi, F.S., Mihm, M.C., Soiffer, R.J., Haluska, F.G., Butler, M., Seiden, M.V., Davis, T., Henry-Spires, R., MacRae, S., Willman, A., Padera, R., Jaklitsch, M.T., Shankar, S., Chen, T.C., Korman, A., Allison, J.P. & Dranoff, G. (2003). Biologic activity of cytotoxic T lymphocyte-associated antigen 4 antibody blockade in previously vaccinated metastatic melanoma and ovarian carcinoma patients. Proc Natl Acad Sci USA, 100(8), 4712-4717.






Komentar berhasil disembunyikan.