Halo Sobat Seratus.
Tentu Sobat Seratus pernah belajar Kimia.
Kimia adalah salah satu cabang Ilmu Sains yang mempelajari sifat, struktur, susunan, energi dan perubahannya yang terjadi pada zat dan materi.
Untuk memahami ilmu ini, para ilmuwan telah sejak lama menyusun atau mengelompokan unsur-unsur yang ada di alam semesta berdasarkan sifat-sifat fisis dan kimiawinya. Penyusunan ini dimulai dari pengelompokan unsur secara sederhana sampai pada sistem periodik yang kita kenal dewasa ini.

Awalnya para ilmuwan menyebutkan bahwa unsur-unsur yang ada di alam ini terdiri atas empat unsur yaitu: Air, Angin, Api dan Tanah. Pemahaman ini cukup lama dipercaya oleh masyarakat. Bahkan memengaruhi cara pandang kebudayaan-kebudayaan maju di dunia saat itu seperti di Yunani.
Kemudian Lavoiser dalam buku Elementary Treatise of Chemistry (1789) mengelompokan unsur-unsur yang telah cukup banyak diketemukan saat itu dalam dua kelompok. Yaitu Logam dan Non Logam.
Kemudian 30 tahun kemudian seorang ilmuwan Kimiawan Jerman yang bernama Johan Wolfgang Dobereiner menyebutkan bahwa ada hubungan yang erat antara sifat unsur dengan massa atomnya. Sehingga lahirlah apa yang dikenal dengan nama Triade Dobereiner. Pada triade ini unsur-unsur dikelompokkan berdasarkan kemiripan sifat dan terdiri dari tiga unsur dimana massa atom unsur kedua sama dengan rata-rata massa atom unsur pertama dan ketiga.
Contoh pada triade Li, Na, K disebutkan bahwa massa atom Na adalah rata-rata dari massa atom Li dan massa atom K.
Susunan ini kemudian disempurnakan oleh Kimiawan Inggris yang bernama John Newlands pada 1864. Kimiawan yang lahir 26 November 1837 ini mampu menunjukkan kesamaan sifat-sifat pada unsur pertama dengan unsur kedelapan, sifat unsur kedua dengan unsur kesembilan dan seterusnya. Atau dengan kata lain bahwa sifat-sifat unsur akan muncul berulang secara periodik setelah 8 unsur. Hukum inilah yang kemudian dikenal dengan nama Hukum Oktaf/Oktet dari Newlands.
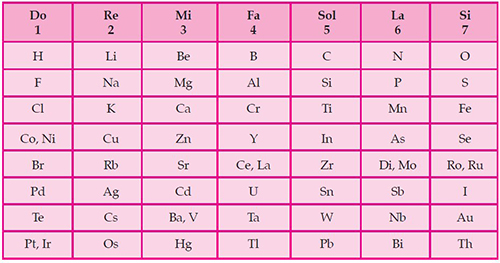
Susunan unsur-unsur hasil pemikiran Newlands ini adalah susunan unsur-unsur yang disajikan dalam bentuk periodik pertama kali.
Tentu selanjutnya kita mengetahui bahwa apabila gas-gas ideal (He, Ne, Ar dst) tidak ditemukanpun, Tabel Periodik Unsur karya Newlands ini hanya berlaku pada unsur-unsur bernomor atom rendah.

Karenanya susunan ini disempurnakan oleh Ilmuwan Rusia Dmitri Ivanovic Mendeleev. Kimiawan yang lahir 8 Februari 1834 ini menyusun Sistem Periodik Unsur-nya berdasar kenaikan massa atomnya (periode) dan kemiripan sifat (golongan). Unsur-unsur dalam satu periode disusun secara horizontal sedangkan unsur-unsur dalam satu golongan disusun secara vertikal.
Kelebihan dari Tabel Berkala Mendeleev ini ternyata mampu memprediksikan unsur-unsur yang saat itu belum diketemukan dengan memberikan kotak kosong seperti untuk Skandium, Galium dan Germanium.

Tabel Mendeleev
Sedangkan kelemahan dari Sistem Periodik Mendeleev ini adalah pada beberapa unsur, penempatannya tidak sesuai dengan kenaikan nomor massanya. Contohnya antara Telurium (Ar = 128) dengan Iodium (Ar = 127).
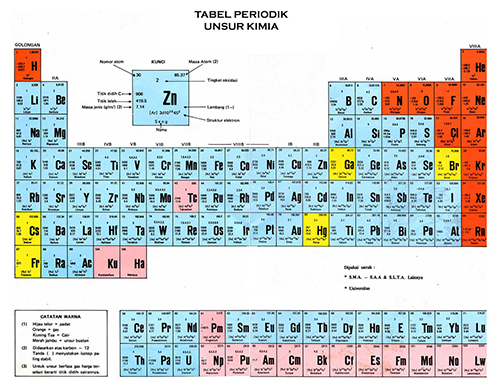
Akhirnya Sistem Periodik Unsur ini disempurnakan oleh Henry Moseley pada tahun 1914.
Berbeda dengan Mendeleev yang menyusun Sistem Periodik berdasarkan massa Atom, Moseley menyusun Sistem Periodiknya berdasarkan nomor Atom.
Sistem Periodik Moseley inilah yang sekarang banyak digunakan oleh kita sekarang.
Demikian sejarah penyusunan Sistem Periodik Unsur. Apabila Sobat Seratus ingin untuk memperdalam tentang sejarah ini, Sobat Seratus dapat melihat video yang terdapat pada laman ini.






Komentar berhasil disembunyikan.